在生命科學領域,蛋白質是生命活動的核心,其功能不僅取決于自身的組成,更與其在細胞或組織內的具體空間位置密切相關。因此,精確解析蛋白質的空間分布,對于揭示疾病發生機制和推動藥物研發具有至關重要的意義。隨著研究的深入,科學家們致力于繪制蛋白質在復雜組織環境中的三維分布圖譜,這對用于樣本前處理的精密器械,特別是能夠實現微米級結構操控的工具,提出了極高的標準需求。
美國紐約州立大學布法羅分校的曲峻(Jun Qu)教授團隊所開發的微型支架輔助空間蛋白質組學(MASP)方法取得了關鍵突破。該方法的核心創新之一,是引入了一種特制的六邊形微型支架,能夠將完整的組織樣本進行精確的微區室化分割。研究團隊通過采用摩方精密的微納3D打印系統,成功制備出微孔達到50微米的高精度六邊形微型支架,為后續實現高通量、高靈敏度的蛋白質組學分析奠定了堅實的基礎,提供了研究全組織水平蛋白質空間分布的全新解決方案。
01 技術瓶頸:微納制造挑戰生命科學極限
在曲峻教授團隊開發的MASP方法中,實現全組織蛋白質空間分布精準測繪的關鍵,在于一種能夠將完整組織樣本進行精確微區室化分割的微型支架。這類微型支架需同時滿足微米級精度與適宜的機械穩定性兩大條件,以確保在復雜生物樣品處理過程中維持結構完整,避免交叉污染。
然而,傳統微加工技術難以實現兼具高精度與復雜三維結構的微型支架批量制備。盡管已有技術路線如雙光子聚合3D打印能夠實現超高的打印精度,但其加工效率低、成型尺寸受限,且設備成本高昂,難以支撐大規模、可重復的生物醫學應用需求。微型支架的制造精度直接關系到組織分割的準確性,進而影響后續蛋白質組學分析的空間分辨率和數據可靠性。
然而,當微型支架存在結構不均一或尺寸偏差的問題時,將會導致蛋白質定位信息失真,嚴重影響研究結論的準確性。因此,微納3D打印技術因其高精度與良好的可控性,是制備微型支架的理想方案。

圖1. 顯微鏡下的微型支架結構。
02 創新突破:實現極限特征支架制造
基于由摩方精密的面投影微立體光刻(PμSL)技術(nanoArch? S140,精度:10μm)制備出的六邊形微型支架,研究團隊成功構建了一套完整的空間蛋白質組學分析流程,其主要環節包括:
組織微區室化與精準采樣:利用定制設計的微型支架對完整組織樣本進行結構規整的微區劃分,在空間上隔離不同功能區域,為后續分析提供定位準確的微量樣本。
微尺度樣本前處理與酶解:在每個微區室內完成蛋白質提取、酶解等步驟,用于液相色譜-質譜聯用分析。
蛋白質圖譜構建與數據分析:整合質譜鑒定結果與微區室空間坐標信息,重建全組織范圍內的高分辨率蛋白質分布圖譜。
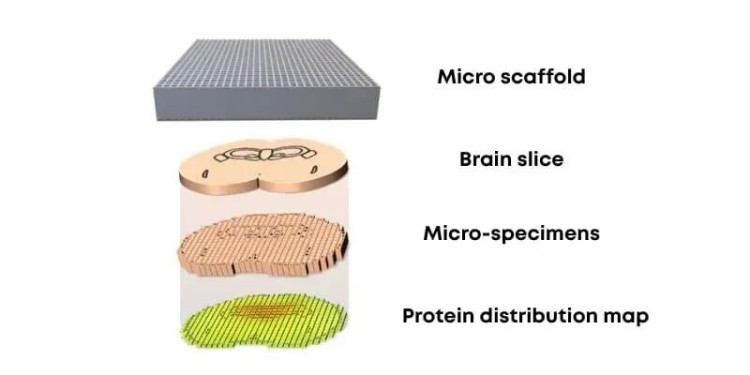
圖2. 微型支架輔助空間蛋白質組學方法示意圖。

圖3. 通過PμSL技術制備的六邊形微型支架,分辨率、效率和機械強度顯著提升。
03應用成果:推動空間蛋白質組學進入新時代
基于經過高精度支架升級的MASP平臺,本研究繪制了健康小鼠全腦內約1萬種蛋白質及3萬多個磷酸化位點的高分辨率空間分布圖譜,并驗證了圖譜的可靠性。
研究更一步揭示了以往難以觀測到的精細空間分布模式,在不同腦區結構中識別出大量新的區域富集蛋白。改進后的MASP方法還拓展至藥物研究領域,使得研究人員能夠可視化抗體藥物在腦內的分布,為藥物遞送及其局部組織反應的研究提供了新的視角。
據研究團隊稱,在制備所需的高保真微型支架方面,僅有摩方精密的打印系統能夠滿足要求,其他技術方案均無法實現如此高的精度。曲峻教授曾這樣評價到:“摩方精密的微納3D打印系統所具有的精確性和可靠性,使得我們能夠以前所未有的深度和準確度,繪制全組織層面的蛋白質空間信息圖譜。在摩方技術的支持下,我們團隊成功開發了能夠推動空間生物學邊界的新方案,這為生物醫學和藥物研究中的組織異質性研究帶來了新的機遇。”
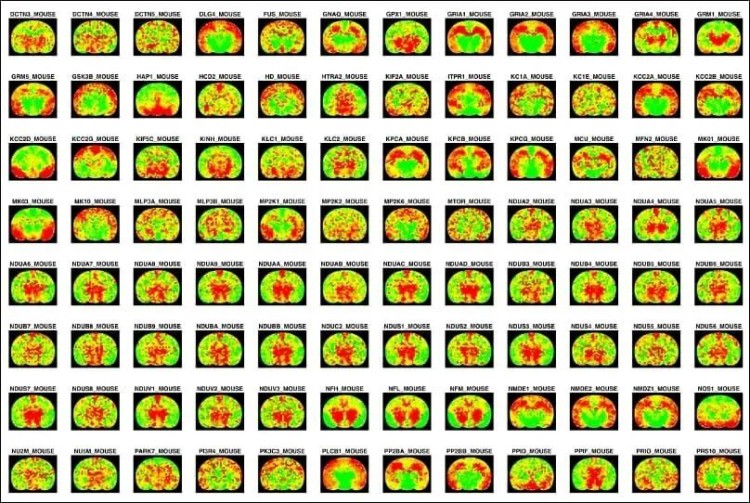
圖4. MASP技術生成的全組織蛋白質分布圖,展示了空間蛋白質組圖譜的高靈敏度特征。
04技術展望:微納制造賦能生命科學的未來
摩方精密在空間蛋白質組學領域的突破,只是微納制造技術賦能生命科學的一個縮影。隨著相關技術不斷迭代,高精度3D打印在生物醫學領域的應用展現出廣闊潛力。
從演進路徑來看,高精度3D打印技術正朝著多功能集成與智能化制造的方向深化發展。摩方精密已在此方向積極布局,其技術體系逐步向精度極限不斷逼近、材料體系持續擴展、制造流程日益智能化演進。
在市場覆蓋方面,摩方精密的超高精度3D打印系統已服務全球40個國家的近3000家科研機構與工業企業,客戶涵蓋國際頂尖的醫療器械企業、精密連接器制造商以及消費電子行業領導者。即便在德國、日本、美國等具有深厚精密制造基礎的國家,其設備也在穩步支撐多個前沿科學領域的創新研究。
當高精度制造技術真正融入實際應用場景,其核心價值——精度,才得以充分彰顯。











